微软研究院近期在人工智能领域迈出了重要一步,于2月20日正式揭晓了其最新研发成果——AI模型BioEmu-1。这一创新模型能够预测蛋白质随时间流逝的运动轨迹及形状变化,为生物医学、药物研发以及结构生物学等多个领域带来了前所未有的可能性。
蛋白质,这一生命活动的基石,在维系生命健康中发挥着至关重要的作用。从构建肌肉纤维到抵御外来疾病的侵袭,蛋白质的身影无处不在。近年来,科学家借助深度学习技术,在蛋白质结构研究领域取得了显著突破,能够根据氨基酸序列精确预测蛋白质的三维结构。然而,这种预测仅停留在静态层面,如同电影中的单帧画面,难以全面捕捉蛋白质这一高度灵活分子的动态特性。
BioEmu-1的问世,则打破了这一局限。与DeepMind的AlphaFold专注于静态结构预测不同,BioEmu-1能够模拟蛋白质在不同构象间的动态转换过程,为科学家提供了理解蛋白质运动机制、设计精准治疗方案的新工具。AlphaFold 3虽然在结构生物学领域取得了显著进步,改进了蛋白质与其他分子的相互作用模型,但在预测蛋白质随时间变化方面仍显不足。
BioEmu-1利用生成式深度学习技术,从海量数据集中学习蛋白质结构的内在规律,并生成与这些规律相符的新样本。其训练过程结合了静态蛋白质结构数据、分子动力学模拟数据以及实验稳定性数据,确保了预测结果的准确性和可靠性。BioEmu-1的核心机制是一个扩散模型,通过迭代生成蛋白质结构,并根据学习到的约束条件不断优化其准确性。
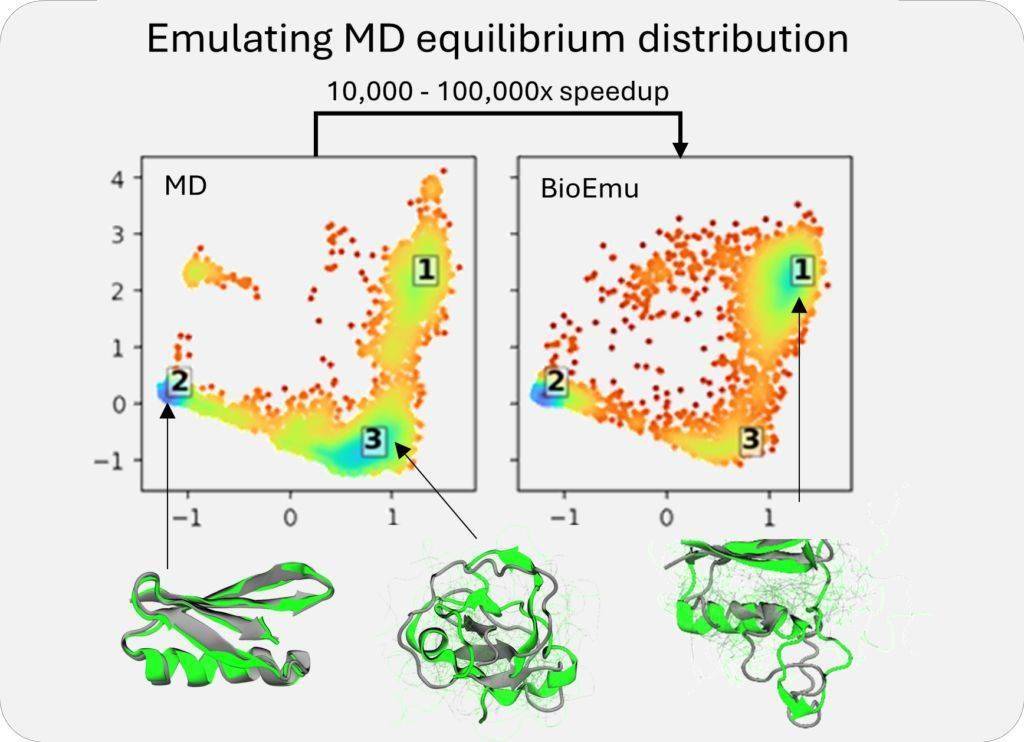
BioEmu-1的关键输出包括平衡系综的预测和自由能的预测。为了提升其预测能力,BioEmu-1采用了三种类型的数据集进行训练:AlphaFold数据库中的结构数据、广泛的分子动力学模拟数据集以及实验性蛋白质折叠稳定性数据集。这些丰富的数据集使得BioEmu-1能够识别蛋白质序列与多个不同结构之间的映射关系,预测合理的结构变化,并以正确的概率对折叠和未折叠结构进行采样。
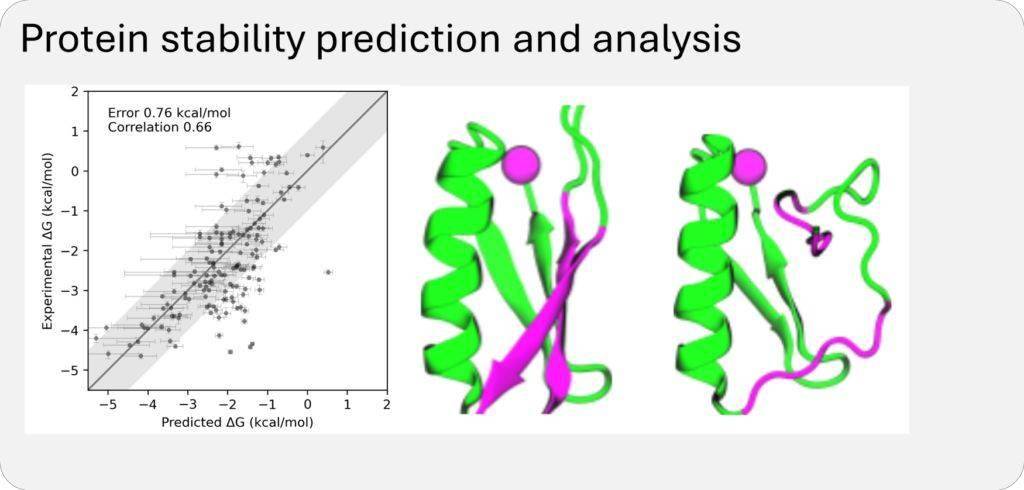
BioEmu-1在预测效率上实现了显著提升。每小时可生成数千个蛋白质结构样本,相较于传统分子动力学模拟需要数周的时间,BioEmu-1无疑大大加快了研究速度,降低了计算成本。同时,其预测自由能的误差幅度控制在1 kcal/mol以内,与传统分子动力学模拟相当,但计算成本却得到了显著降低。
BioEmu-1的成功研发,不仅标志着微软研究院在人工智能领域的又一次重大突破,更为生物医学、药物研发等领域的科学家们提供了强有力的支持。随着BioEmu-1的广泛应用,相信未来在蛋白质结构预测、疾病治疗等方面将取得更多令人瞩目的成果。